На сьогоднішній день черепно-мозкова травма (ЧМТ) є одним з найбільш часто зустрічаються видів неврологічної патології і являє собою істотну медичну і соціально-економічну проблему для всіх верств населення.
зміст
У розвинених країнах спостерігається неухильне зростання нейротравматізма. Так в країнах Європи щорічно реєструється 150–300 випадків ЧМТ на 100 тис. населення. У США тільки за 2003 р. зазначалося більш 1,5 млн випадків ЧМТ. У Росії ця цифра сягає 4 випадків на 1 тис. людина. Найбільш важливою проблемою в медико-соціальному плані є те, що у значної кількості постраждалих в подальшому розвиваються так звані наслідки перенесеної ЧМТ, часто трактуються в рамках посттравматичної енцефалопатії. У числі найпоширеніших синдромів, що визначають рівень соціально-побутової адаптації та якість життя хворих, перебувають інтелектуально-мнестичні порушення. Посттравматичні когнітивні порушення ізольовано спостерігаються у 29,4% всіх хворих з наслідками ЧМТ, а в поєднанні з іншими синдромами — у 35,7%. В цілому, серед наслідків перенесеної ЧМТ когнітивні порушення як синдром зустрічаються в 65,1% випадків.
Патогенез розвитку посттравматичних когнітивних розладів вельми складний і багатогранний. В якості основних факторів, здатних привести до формування когнітивного дефіциту в гострому періоді, розглядаються як безпосереднє механічне пошкодження тканин головного мозку, так і опосередкований вплив певних патофізіологічних процесів, що виникають при ЧМТ, таких як набряк-набухання головного мозку, порушення ликворо-, гемодинаміки і ін. У той же час відомо, що в частині випадків розлади інтелектуально-мнестичних функцій зберігаються тривалий час або носять стійкий характер. У інших хворих вони з'являються в віддаленому періоді травми і мають чітку тенденцію до прогресування. Механізм виникнення таких порушень залишається вивченим в необхідній мірі. Отримані дані свідчать про те, що впливають на нервову клітину в гострому періоді патологічні фактори сприяють виникненню каскаду біохімічних зрушень в нейронах, що призводять до розвитку в них дистрофічних процесів і зниження ефективності синаптичної передачі.
В кінцевому підсумку відбувається порушення процесів розповсюдження інформації в нейронних мережах, що розглядається в якості одного з основних аспектів формування когнітивних порушень. Ряд дослідників відзначають певну схожість патогенетичних механізмів розвитку когнітивних порушень при ЧМТ та судинних ураженнях головного мозку. Крім того, показана можлива роль травми мозку як пускового фактора нейродегенеративних захворювань, зокрема хвороби Альцгеймера. В даний час розглядається кілька патофізіологічесчкіх процесів, які грають значну роль у формуванні посттравматичних когнітивних розладів.
Одним з таких процесів є розвиток «глутаматной ексайтотоксічності». У фізіологічних умовах глутамат виступає в якості одного з найважливіших збуджуючих медіаторів центральної нервової системи, беручи участь в здійсненні процесів нейрональної пластичності і інтеграційних функцій головного мозку. Значна кількість глутаматергіческіх рецепторів спостерігається в корі головного мозку і гіпокампі. У той же час при патології спостерігається надлишковий викид глутамату, який в даних умовах надає токсичну дію на нейрональні структури, що сприяє активації реакцій глутамат-кальцієвого каскаду, що призводять до неконтрольованого підвищення концентрації внутрішньоклітинного кальцію, який надає негативний вплив на енергозабезпечення клітини. Показано, що в умовах ішемії в тканинах відбувається значне підвищення рівня освіти вільних радикалів, чому також сприяє надмірне внутрішньоклітинний накопичення кальцію.
Головний мозок дуже чутливий до дії вільних радикалів. В умовах переважання оксидантних систем над антиоксидантними відбувається формування так званого оксидантного стресу. При цьому стані активується гідроліз фосфолипаз і відбувається деградація клітинних мембран, в тому числі мітохондріальних. Усунення виникаючих порушень є необхідною умовою для успішного ведення пацієнтів з посттравматичними когнітивними порушеннями. З цих позицій є доцільним призначення такого препарату, як ноопепт, що володіє подібними властивостями. Ноопепт — етиловий ефір N-феніл-ацетил-L-пролілгліціна — новий вітчизняний оригінальний дипептид, створений в НДІ фармакології їм. В.В.Закусова РАМН. За отриманими в ході експериментальних досліджень даними ноопепт володіє ноотропні і нейропротектівнимі властивостями. Препарат за своїми структурно-конформаційних характеристик схожий з пірацетамом і вазопресином. Розробка даного препарату проводилася в рамках існуючого уявлення про те, що деякі регуляторні пептиди впливають на механізми формування пам'яті і навчання.
В основі пояснення дії НООПЕПТУ лежить гіпотеза про те, що базовий препарат цієї групи пірацетам є аналогом пептидного лиганда до специфічних ноотропним рецепторів, подібним за своїми характеристиками з метаболітами вазопресину. Ноопепт вигідно відрізняється від вазопресину тим, що здатний виявляти активність при системному, в тому числі і пероральному прийомі. В ході проведених досліджень була показана висока біодоступність препарату для тканин головного мозку, а також його низька токсичність. Вивчення в експерименті на лабораторних тваринах дозволило встановити, що використання дозувань препарату, від 2 до 20 разів перевищують ноотропні, не викликає ушкодження внутрішніх органів, не робить значних порушень гематологічних і біохімічних показників. При проведенні цілого ряду клінічних досліджень також показана висока безпека препарату і його добра переносимість. В ході проведених досліджень було встановлено, що ноопепт має комплексний механізм дії.
По-перше, він надає ноотропний ефект, пов'язаний з тим, що одним з активних метаболітів НООПЕПТУ є циклопролілгліцину, який за своєю структурою аналогічний ендогенному циклічному дипептиду, котрий володіє антиамнестичну активністю.
По-друге, ноопепт здатний підвищувати стійкість мозкової тканини до ушкоджують впливів, таким як травма, гипоксическое, Електросудомна і токсичне ураження, що і характеризує нейропротективное дію даного препарату. По-третє, показана можливість НООПЕПТУ запобігати в умовах дії токсичних концентрацій глутамату і активних форм кисню загибель нейронів у культурі тканини кори головного мозку і мозочка. Крім того, в експерименті виявлена здатність НООПЕПТУ зменшувати токсичну дію b-амілоїду, підсилювати вироблення антіамілоідних антитіл, модулювати роботу холинергических рецепторів, а також стимулювати експресію нейротрофічних факторів (BDNF і NGF) в корі головного мозку і гіпокампі.
Актуальність проблеми посттравматичних когнітивних порушень, обґрунтованість застосування НООПЕПТУ з урахуванням наявності точок прикладання на нейрохимическом рівні при наслідках ЧМТ, а також попередня, в тому числі, і експериментально-клінічна ефективність препарату послужили причиною цього дослідження.
Метою дослідження була оцінка ефективності, а також безпеки застосування препарату ноопепт у пацієнтів з легкими посттравматичними когнітивними порушеннями. Дослідження проводилося за спеціально розробленим протоколу і відповідало всім вимогам належної клінічної практики (GCP), прийнятим в Російській Федерації. У дослідження включалися пацієнти, що відповідали критеріям включення, після обов'язкового підписання інформованої згоди.
У дослідженні брали участь 30 пацієнтів у віці 19–66 років (середній вік 33±10,3 року), які перенесли ЧМТ (струс або забій головного мозку легкого ступеня) не менше 6 міс назад і мають пов'язані з цим станом порушення інтелектуально-мнестичних функцій, які відповідають критеріям синдрому помірних когнітивних порушень. Всі хворі відповідали критеріям синдрому помірних когнітивних порушень, а їх когнітивні порушення початково оцінювалися в 25 або більше балів за шкалою Mini-Mental State Examination (MMSE).
Критеріями виключення з дослідження були: наявність супутніх важких або нестабільних соматичних захворювань, які загрожують життю хворого, наявність клінічно значущих інших (крім синдрому помірних когнітивних порушень при наслідках ЧМТ) неврологічних або психічних порушень, наявність грубого рухового або сенсорного дефекту або інших порушень, які ускладнювали б проведення нейропсихологічного дослідження або інших досліджень, передбачених протоколом, наявність в анамнезі інсульту або дисциркуляторної енцефалопатії III стадії, одночасне проведення терапії іншими вазоактивними, метаболічними або психотропними препаратами, що володіють доведеним когнітивно-стимулюючим ефектом, непереносимість досліджуваного препарату, період вагітності і лактації.
При виконанні роботи для об'єктивізації отриманих даних були застосовані
наступні методи:
1) оцінка неврологічного статусу;
2) коротка шкала оцінки психічного статусу — MMSE;
3) шкали Гамільтона для оцінки депресії;
4) батарея тестів на лобову дисфункцію — Frontal Assessment Battery (FAB);
5) тест малювання годин;
6) тест 10 слів;
7) проба Шульте;
8) рейтингова шкала загального клінічного враження про зміну — Clinician’s Interview Based Impression of Change Plus (CIBIC Plus);
9) нейровізуалізаційні методи: комп'ютерна або магнітно-резонансна томографія.
Оцінка за шкалою загального клінічного враження передбачала оцінку стану пацієнта до терапії і оцінку вираженості змін на тлі лікування. Лікуючий лікар до початку терапії виносив оцінку стану пацієнта на підставі аналізу розладів по 7-бальною шкалою, оцінюючи при цьому клінічну картину захворювання, спостереження за пацієнтом, стан ментальної сфери хворого, поведінка, стан соціально-побутових функцій.
На початку дослідження проводився скринінговий візит, на якому визначалося відповідність пацієнта критеріям включення. Потім в разі відповідності пацієнта протоколу проводилося підписання інформованої згоди. На цьому візиті також оцінювалися результати електрокардіограми, лабораторних і нейровізуалізаційних методів дослідження. Після цього оцінювався неврологічний статус, виконувалося базове нейропсихологическое тестування з метою визначення вихідного рівня стану когнітивних функцій.
Починаючи з наступного за скринінговим візитом дня, пацієнти отримували ноопепт по 10 мг 2 рази на день протягом 60 днів. Надалі оцінка ефективності терапії здійснювалася на 30 і 60-й дні лікування. План заходів, що проводяться представлений в таблиці.
У нашому дослідженні середній термін після перенесеної травми склав 7±3,8 року. Всі 30 пацієнтів, які увійшли до дослідження, початково мали легкі порушення за шкалою загального клінічного враження про зміну (CIBIC Plus). Під час скринінгового візиту всі обстежені хворі пред'являли скарги на зниження пам'яті, концентрації уваги, зниження ефективності виконання заходів повсякденної діяльності, загальну слабкість, підвищену стомлюваність. Крім того, частина хворих пред'являли інші скарги: на головний біль (43,3%), труднощі з плануванням різних заходів (40%), розлад сну (26,7%), нестійкість настрою (23,3%). В ході неврологічного обстеження грубих порушень виявлено не було. У 53,3% пацієнтів спостерігалася розсіяна симптоматика у вигляді ізольованих мікросімптомах, у 13,3% — легкі координаторні порушення. У такої ж кількості спостережуваних були виявлені двосторонні патологічні кистьові рефлекси (Россолімо, Вартенберга). У всіх пацієнтів спостерігалися ознаки астенічного синдрому. У 53,3% спостерігалися ознаки вегетативно-судинної нестійкості.
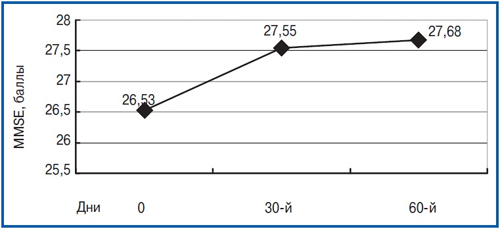
Проведене в динаміці дослідження когнітивних функцій хворих показало, що за результатами шкалою MMSE достовірні відмінності з початковим рівнем були показані через 30 днів після початку лікування. Зокрема, до початку прийому препарату середній бал склав 26,5±0,94; через 1 міс від початку терапії — 27,6±0,99 бала (р<0,01). У той же час через 60 днів від початку терапії середній бал за даною шкалою склав 27,7±1,09, що характеризувало відсутність подальшого достовірного поліпшення (p>0,05) і відображало лише деяку тенденцію до зменшення когнітивних розладів. Динаміка нейропсихологічних показників за шкалою MMSE представлена на рис. 1.
Малюнок 1
Цікавим виявився той факт, що в структурі шкали MMSE найбільш значуще поліпшення показників було отримано по субшкале «увага», характеризує певною мірою стан нейродинамічних процесів, які страждають при ЧМТ (p<0,01), а також по субшкале «пам'ять» (р<0,05). За шкалою батареї тестів для оцінки лобної дисфункції FAB достовірних відмінностей за період спостереження в динаміці отримано не було (на початковому візиті — 15,9±0,78 бала, через 60 днів — 16,8±0,87, p = 0,27). Виконання тесту малювання годин з 10-бальною оцінкою на вихідному візит, як правило, оцінювалося в 9–10 балів і на тлі проведеної терапії істотних змін не зазнало. Безумовний інтерес представляють дані, отримані на підставі оцінки результатів проби Шульте, що виконується на всіх 3 візити. Комплексна оціночна проба із застосуванням 5 послідовно пред'являються пацієнтові таблиць найбільш повно дозволяє охарактеризувати такі нейродинамические зміни, як погіршення концентрації уваги, підвищену виснаженість психічних процесів і нестійкість уваги. Зазначені зміни в певній мірі були властиві більшості пацієнтів на скринінговому візит. Середній час виконання тесту для кожного з п'яти передавальний на першому візиті склало 45,5±6,24 з. Через 2 місяці після початку терапії час зменшилася до 40,2±5,20 с, що характеризувало істотне поліпшення концентрації уваги (р<0,05). Динаміка часу виконання проби Шульте представлена на рис. 2.
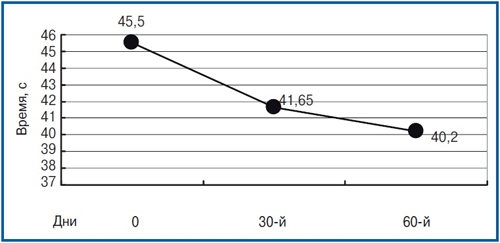
малюнок 2
Як видно з графіка на рис. 2, найбільш істотне зменшення часу, витраченого на виконання проб, було показано пацієнтами вже через 30 днів після початку терапії. Виразна позитивна динаміка також зберігалася протягом 2-го місяця прийому препарату і характеризувалася ще більш вираженим зменшенням часу виконання тесту з менш значною стабілізацією поліпшення, ніж за шкалою MMSE.
Оцінка за шкалою загального клінічного враження передбачала оцінку стану пацієнта до терапії і оцінку вираженості змін на тлі лікування. Лікуючий лікар до початку терапії виносив оцінку стану пацієнта на підставі аналізу розладів по 7-бальною шкалою, оцінюючи при цьому клінічну картину захворювання, спостереження за пацієнтом, стан ментальної сфери хворого, поведінка, стан соціально-побутових функцій.
На початку дослідження проводився скринінговий візит, на якому визначалося відповідність пацієнта критеріям включення. Потім в разі відповідності пацієнта протоколу проводилося підписання інформованої згоди. На цьому візиті також оцінювалися результати електрокардіограми, лабораторних і нейровізуалізаційних методів дослідження. Після цього оцінювався неврологічний статус, виконувалося базове нейропсихологическое тестування з метою визначення вихідного рівня стану когнітивних функцій.
Починаючи з наступного за скринінговим візитом дня, пацієнти отримували ноопепт по 10 мг 2 рази на день протягом 60 днів. Надалі оцінка ефективності терапії здійснювалася на 30 і 60-й дні лікування. План заходів, що проводяться представлений в таблиці.
| Методи дослідження | I | II | III |
| фон | 30 - й день | 60 - й день | |
| Коротка шкала оцінки психічного статусу (MMSE) | V | V | V |
| Оцінка лобової дисфункції (FAB) | V | V | |
| Тест малювання годин 10 – бальною оцінкою | V | V | |
| Шкала загального клінічного враження (СGI) | V | V | |
| Тест 10 слів | V | V | |
| проба Шульте | V | V | V |
| шкала Гамільтона | V | ||
| Оцінка небажаних явищ і побічних ефектів | V | V |
малюнок 3
У нашому дослідженні середній термін після перенесеної травми склав 7±3,8 року. Всі 30 пацієнтів, які увійшли до дослідження, початково мали легкі порушення за шкалою загального клінічного враження про зміну (CIBIC Plus). Під час скринінгового візиту всі обстежені хворі пред'являли скарги на зниження пам'яті, концентрації уваги, зниження ефективності виконання заходів повсякденної діяльності, загальну слабкість, підвищену стомлюваність. Крім того, частина хворих пред'являли інші скарги: на головний біль (43,3%), труднощі з плануванням різних заходів (40%), розлад сну (26,7%), нестійкість настрою (23,3%). В ході неврологічного обстеження грубих порушень виявлено не було. У 53,3% пацієнтів спостерігалася розсіяна симптоматика у вигляді ізольованих мікросімптомах, у 13,3% — легкі координаторні порушення. У такої ж кількості спостережуваних були виявлені двосторонні патологічні кистьові рефлекси (Россолімо, Вартенберга). У всіх пацієнтів спостерігалися ознаки астенічного синдрому. У 53,3% спостерігалися ознаки вегетативно-судинної нестійкості.
Проведене в динаміці дослідження когнітивних функцій хворих показало, що за результатами шкалою MMSE достовірні відмінності з початковим рівнем були показані через 30 днів після початку лікування. Зокрема, до початку прийому препарату середній бал склав 26,5±0,94; через 1 міс від початку терапії — 27,6±0,99 бала (р<0,01). У той же час через 60 днів від початку терапії середній бал за даною шкалою склав 27,7±1,09, що характеризувало відсутність подальшого достовірного поліпшення (p>0,05) і відображало лише деяку тенденцію до зменшення когнітивних розладів. Динаміка нейропсихологічних показників за шкалою MMSE представлена на рис. 1. Цікавим виявився той факт, що в структурі шкали MMSE найбільш значуще поліпшення показників було отримано по субшкале «увага», характеризує певною мірою стан нейродинамічних процесів, які страждають при ЧМТ (p<0,01), а також по субшкале «пам'ять» (р<0,05). За шкалою батареї тестів для оцінки лобної дисфункції FAB достовірних відмінностей за період спостереження в динаміці отримано не було (на початковому візиті — 15,9±0,78 бала, через 60 днів — 16,8±0,87, p = 0,27). Виконання тесту малювання годин з 10-бальною оцінкою на вихідному візит, як правило, оцінювалося в 9–10 балів і на тлі проведеної терапії істотних змін не зазнало.
Безумовний інтерес представляють дані, отримані на підставі оцінки результатів проби Шульте, що виконується на всіх 3 візити. Комплексна оціночна проба із застосуванням 5 послідовно пред'являються пацієнтові таблиць найбільш повно дозволяє охарактеризувати такі нейродинамические зміни, як погіршення концентрації уваги, підвищену виснаженість психічних процесів і нестійкість уваги. Зазначені зміни в певній мірі були властиві більшості пацієнтів на скринінговому візит. Середній час виконання тесту для кожного з п'яти передавальний на першому візиті склало 45,5±6,24 з. Через 2 місяці після початку терапії час зменшилася до 40,2±5,20 с, що характеризувало істотне поліпшення концентрації уваги (р<0,05). Динаміка часу виконання проби Шульте представлена на рис. 2. Як видно з графіка на рис. 2, найбільш істотне зменшення часу, витраченого на виконання проб, було показано пацієнтами вже через 30 днів після початку терапії. Виразна позитивна динаміка також зберігалася протягом 2-го місяця прийому препарату і характеризувалася ще більш вираженим зменшенням часу виконання тесту з менш значною стабілізацією поліпшення, ніж за шкалою MMSE.